Het behandellandschap van multipel myeloom (MM) is het afgelopen decennium drastisch veranderd door de introductie van nieuwe middelen, die hebben geleid tot een significante verbetering in de mediane algemene overleving.1-3 Immuunmodulatoire middelen (‘immunomodulatory drugs’, IMiD’s), zoals lenalidomide en pomalidomide; proteasoomremmers (‘proteasome inhibitors’, PI’s), zoals bortezomib, carfilzomib en ixazomib; en monoklonale antistoffentherapie, zoals daratumumab en elotuzumab, zijn de laatste jaren goedgekeurd voor de behandeling van MM. Deze middelen hebben inmiddels hun plek gevonden binnen de klinische richtlijnen en hebben de behandelopties voor MM-patiënten uitgebreid.1,4
Voor jongere patiënten met een goede klinische conditie bestaat de standaard eerstelijnsbehandeling uit inductietherapie gevolgd door een autologe stamceltransplantatie (ASCT), waarna onderhoudstherapie met lenalidomide volgt. Voor de oudere, minder fitte patiënt wordt gekozen tussen een PI-bevattend, danwel een IMiD-bevattend regime en wordt in principe niet toegewerkt naar een ASCT. Om te bepalen of een oudere patiënt al dan niet fit is, kan gebruik worden gemaakt van verschillende scores. Het meest gebruikte meetinstrument bij MM-patiënten is de ‘International Myeloma Working Group’ (IMWG) ‘frailty’-score, die patiënten categoriseert als fit, niet fit of kwetsbaar op basis van leeftijd, comorbiditeiten en eventuele beperkingen in algemene dagelijkse levensverrichtingen (ADL) en in instrumentele activiteiten in het dagelijks leven (iADL). Deze score heeft een voorspellende waarde voor de overleving en het risico op toxiciteit bij oudere MM-patiënten. Fitte patiënten bleken een 3-jaarsoverleving van 91% te hebben, bij niet fitte patiënten was dit 77% en bij kwetsbare patiënten 47%.5 Daarom betreft het advies bij iedere MM-patiënt boven de 70 jaar deze frailty-score te bepalen om de therapiekeuze te ondersteunen.
In gesprek met:
Dr. Inger Nijhof
hematoloog, Amsterdam UMC, locatie VUmc
Dr. Nijhof is werkzaam als hematoloog in het Amsterdam UMC, locatie VUmc, met als aandachtsgebied MM en immunotherapie. Ze vertelt over de mogelijkheden voor de eerstelijnsbehandeling bij patiënten die niet in aanmerking komen voor ASCT en het belang van een optimaal bijwerkingenmanagement bij deze patiëntengroep.
De mogelijkheden voor de eerstelijnsbehandeling van MM-patiënten die niet in aanmerking komen voor ASCT waren de afgelopen jaren het PI-bevattende regime MPV (melfalan-prednison-bortezomib) of het IMiD-bevattend regime Rd (lenalidomide-dexamethason). Een recente ontwikkeling is dat daratumumab toegevoegd kan worden aan MPV (Dara-MPV), waardoor de effectiviteit en de duur van de respons toeneemt. Toevoeging van daratumumab aan Rd is vooralsnog alleen nog goedgekeurd in de recidiefsetting.
FACTOREN DIE VAN INVLOED ZIJN OP DE THERAPIEKEUZE Nijhof vertelt dat de keuze voor een behandelregime afhankelijk is van verschillende factoren. “De keuze voor een behandeling wordt gemaakt op basis van hoe het myeloom zich bij de patiënt presenteert, maar ook naar aanleiding van de voorkeur van de patiënt zelf. Zo is Rd volledig oraal en moeten patiënten voor MPV vaker naar het ziekenhuis komen, omdat bortezomib in dit regime op de dagbehandeling wordt toegediend. Vooral voor oudere, minder mobiele patiënten en/of patiënten die wat verder weg wonen, kan dat een reden zijn om een voorkeur voor behandeling met Rd te hebben.” Daarnaast is het van belang om de fitheid van een patiënt in te schatten, onafhankelijk van de leeftijd. “De IMWG frailty-score is een gebruiksvriendelijk meetinstrument, dat snel kan worden ingezet om te bepalen hoe fit een patiënt is”, aldus Nijhof. “Je kunt de test samen met de patiënt invullen of de patiënt kan zelf al een deel invullen. Bovendien is de test opgenomen in de Hematology App, waarin deze ook snel ingevuld kan worden. Dat is van belang, omdat je de behandeling zo snel mogelijk wilt inzetten. Wanneer patiënten kwetsbaar zijn, wordt voorzichtigheid geboden met betrekking tot het aantal middelen dat wordt toegediend en de doseringen waarin deze worden toegediend. Door meer bijwerkingen kan een behandeling minder goed vol te houden zijn. Een fitte patiënt kan meer aan dan een niet-fitte patiënt. Bij kwetsbare patiënten moet de behandeling vaker vroegtijdig gestaakt worden, of moeten frequenter dosisaanpassingen worden toegepast.”
Verder speelt comorbiditeit een rol in de therapiekeuze. “Als iemand al ernstige polyneuropathie heeft, door bijvoorbeeld diabetes, dan zal er wat minder snel worden gekozen voor MPV en wat sneller voor Rd”, licht Nijhof toe. “Tot slot heeft de manier waarop de ziekte zich uit hier ook invloed op. Bij ernstige nierfunctiestoornissen gaat de voorkeur uit naar het PI-bevattende regime, omdat daarbij een snellere respons wordt verwacht en de nieren niet te lang aan potentiële schade worden blootgesteld. Bij een prognostisch ongunstig cytogenetisch profiel van de tumorcellen gaat de voorkeur ook uit naar MPV. Echter, als daratumumab straks aan Rd in de eerstelijnssetting mag worden toegevoegd, dan verschuiven deze principes naar verwachting weer. Door de snelle ontwikkelingen binnen dit veld, zijn al deze keuzes continu aan verandering onderhevig.”
KWETSBARE MM-PATIENTEN Door in- en exclusiecriteria van eerdere studies naar de behandeling van MM bij de oudere patiënt, bestond de onderzoekspopulatie in deze studies voornamelijk uit fitte patiënten. Kwetsbare oudere patiënten werden niet geïncludeerd, waardoor uit de resultaten van deze studies geen specifieke conclusies voor de kwetsbare MM-patiënt getrokken kunnen worden. Daar is onlangs echter verandering in gekomen. Nijhof: “De HOVON 143-studie is één van de eerste studies die zich echt richt op niet-fitte en kwetsbare MM-patiënten. Deze patiënten worden behandeld met daratumumab en ixazomib (een orale proteasoomremmer, die goed wordt verdragen). De hypothese is dat dit regime voor deze kwetsbare patiënten goed te tolereren is en daardoor ook beter is vol te houden. Dit zou zich kunnen vertalen in een gunstiger bijwerkingenprofiel en uiteindelijk een overlevingsvoordeel. Vorig jaar werd tijdens ASH een presentatie gegeven over de eerste 20 patiënten geïncludeerd in deze studie, waarin werd getoond dat de behandeling inderdaad goed wordt verdragen. Dit jaar zal tijdens ASH een update van de resultaten worden gepresenteerd en zullen ook de eerste effectiviteitsdata van de interimanalyse worden getoond.”
BIJWERKINGEN Nieuwe middelen brengen ook weer nieuwe bijwerkingen met zich mee. Nijhof noemt de meest voorkomende bijwerkingen. “Polyneuropathie kan optreden, met name bij patiënten die al een polyneuropathie hadden door bijvoorbeeld diabetes. Afwijkende bloedwaarden kunnen niet alleen door de onderliggende aandoening, maar ook door de therapie worden veroorzaakt. Een andere bijwerking die zowel door MM als door de behandeling – met name door lenalidomide – kan worden veroorzaakt is trombose. Patiënten die worden behandeld met dexamethason hebben vaak last van een minder goede nachtrust en een ontregelde glucosehuishouding. Patiënten kunnen daarnaast psychisch ontregeld raken en krijgen een dunnere huid en brozere nagels. Dit middel wordt bij ouderen patiënten in een verlaagde dosis gegeven. Tot slot komen infecties regelmatig voor bij MM-patiënten, veroorzaakt door de beenmergziekte zelf of als bijwerking van de behandeling.”
Het is van belang om deze bijwerkingen goed te monitoren en tijdig in te grijpen. “Als de dosis op tijd wordt aangepast, kunnen de bijwerkingen goed worden gemanaged en hoeft de therapie niet per se te worden gestopt vanwege te ernstige bijwerkingen”, benadrukt Nijhof. “Om de ziekte te behandelen heeft het de voorkeur om door te gaan met de behandeling, zonodig in een lagere dosering. Als de patiënt de therapie langer kan volhouden met behulp van dosisaanpassingen, kan dit de ziektecontrole en overleving ten goede komen. Sommige bijwerkingen kunnen bovendien dusdanig ernstig van aard worden, dat ze niet meer volledig omkeerbaar zijn (zoals sommige vormen van polyneuropathie). De kwaliteit van leven is voor deze patiëntengroep een zeer groot onderdeel van de keuzes die ze maken: de therapie moet goed te verdragen zijn en de levensduur verlengen op een zo prettig mogelijke manier.”
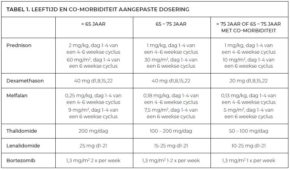
Door middel van dosisaanpassingen kan bij kwetsbare patiënten dus geanticipeerd worden op bijwerkingen. In de richtlijn MM is een ‘expert-based opinion’ tabel opgenomen, waarin per middel een advies wordt gegeven met betrekking tot dosisaanpassingen op basis van leeftijd, comorbiditeiten en bijwerkingen (zie Tabel 1).
Tabel 1.
Leeftijd en co-morbiditeit aangepaste dosering
“Bij kwetsbare patiënten kan de dosis vooraf al aangepast worden”, legt Nijhof uit. “Als de patiënt vervolgens opknapt door de therapie en minder kwetsbaar lijkt, kan de dosis eventueel weer wat worden verhoogd. De tabel adviseert vanuit de werkgroep, geleid door prof. dr. Sonja Zweegman, hoe je in de dagelijkse praktijk kunt omgaan met dosisaanpassingen. Zo proberen we het samen op een zo uniform mogelijke manier te doen.”
Voor veel voorkomende bijwerkingen worden er specifieke voorzorgsmaatregelen geadviseerd in de behandelrichtlijn MM. “Tegenwoordig is het advies alle MM-patiënten te vaccineren tegen specifieke bacteriën (zoals pneumokokken en Haemophilus influenza B) om het risico op infecties te verlagen. Bij behandelingen die extra risico geven op infecties, wordt als ondersteunende therapie antibiotica gegeven. Als bijvoorbeeld levofloxacine gedurende de eerste 12 weken aan de behandeling wordt toegevoegd, kan de overleving en morbiditeit van de patiënt worden verbeterd.6 Een ander voorbeeld is de profylactische toediening van valaciclovir om gordelroos te voorkomen. Er zijn legio methoden om de kans op bijwerkingen zo laag mogelijk te maken of er snel op te anticiperen als ze optreden.”
DE TOEKOMST Volgens Nijhof zal het veld van MM voorlopig in beweging blijven. “Door de studies die nu nog lopen, zal de definitie van kwetsbare patiënten steeds verder door ontwikkelen. Hierdoor kunnen we nog beter beslissingen maken over welk behandelregime het beste past bij deze patiënten. Daarnaast blijven er steeds nieuwe middelen bij komen, zoals immuuntherapieën. De vraag is of deze nieuwe therapieën ook aan oudere en/of kwetsbare patiënten kunnen worden aangeboden met betrekking tot verdraagzaamheid en effectiviteit. Het bijwerkingenprofiel van de nieuwe middelen wordt bovendien steeds bekender, waardoor we daar steeds beter mee zullen kunnen omgaan.” Nijhof benadrukt tot slot dat de keus van de patiënt centraal moet blijven staan. “Uiteindelijk moeten we van de patiënt uit blijven gaan. Wat is mogelijk en wat wil de patiënt? Bij een kwetsbare, oudere patiënt is de kwaliteit van leven extra belangrijk. De tijd die je extra krijgt, moet zo goed mogelijk zijn en niet verslechteren door de behandeling.”
Referenties
1. Moreau P, San Miguel J, Sonneveld P, et al. ESMO Guidelines Committee. Multiple myeloma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28(suppl 4):iv52-iv61.
2. Kumar SK, Dispenzieri A, Lacy MQ, et al. Continued improvement in survival in multiple myeloma: changes in early mortality and outcomes in older patients. Leukemia. 2014;28(5):1122-1128.
3. Rajkumar SV. Myeloma today: Disease definitions and treatment advances. Am J Hematol. 2016;91(1):90-100.
4. Kumar SK, Callander NS, Alsina M, et al. Multiple Myeloma, Version 3.2017, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2017;15(2):230-269.
5. Palumbo A, Bringhen S, Mateos MV, et al. Geriatric assessment predicts survival and toxicities in elderly myeloma patients: an International Myeloma Working Group report. Blood. 2015;125(13):2068-2074.
6. Drayson MT, Bowcock S, Planche T, et al. Levofloxacin prophylaxis in patients with newly diagnosed myeloma (TEAMM): a multicentre, double-blind, placebo-controlled, randomised, phase 3 trial. The Lancet. 2019;20(12):1760-1722.