De FDA heeft een speciale status verleend aan gentherapie obecabatagene autoleucel (obe-cel) als behandeling voor patiënten met recidief or refractair B-cel acute lymfatische leukemie (ALL). Het gaat om een zogeheten Regenerative Medicine Advanced Therapy (RMAT) status. Die is bedoeld om mogelijke nieuwe behandelingen toe te laten die in staat kunnen zijn om aan een significante zorgvraag te beantwoorden bij patiënten met ernstige of levensbedreigende ziekten.
De EMA kondigde in maart 2022 aan dat obe-cel de status van weesgeneesmiddel had gekregen. Die status wordt toegekend aan geneesmiddelen voor zeldzame ziekten met een hoge ziektelast, en gaat gepaard met specifieke ontwikkelingsvoordelen en gunstige voorwaarden.
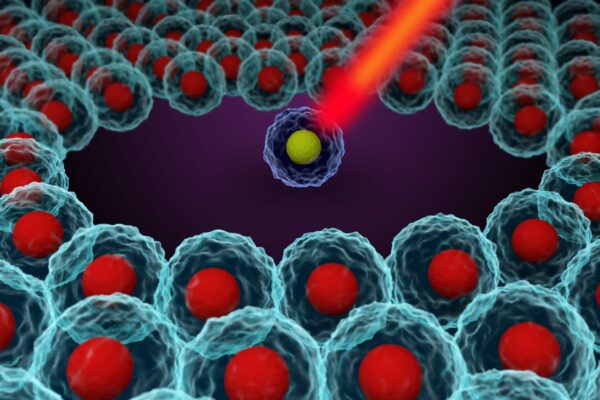
Obe-cel is een autologe CAR-T-celtherapie die is ontwikkeld door Autolus Therapeutucs, een biofarmaceutisch bedrijf dat zich specialiseert in het ontwikkelen van T-celtherapieën. De werkzaamheid en het bijwerkingenprofiel van obe-cel voor patiënten met B-cel ALL zal worden onderzocht in de FELIX-studie, een fase II-studie. Dit is een internationale multicenter studie die plaats zal vinden in de Verenigde Staten en Europa, en waarvoor ongeveer 140 patiënten geïncludeerd zullen worden. Als voornaamste eindpunt van de studie geldt algehele respons ratio. Secundaire studiedoelen zijn duur van de respons, bijwerkingenprofiel en minimale restziekte (MRD).
Referentie